文丨星星狐
11月11日,NMPA 官网显示亚盛医药的奥雷巴替尼(HQP1351)的上市申请(受理号:CXHS2000038)进入在审批阶段,预计将在近日获批。这意味着国内首款针对BCR-ABL中T315I突变的酪氨酸激酶抑制剂---奥雷巴替尼即将获批上市!
三年前,徐峥主演的电影《我不是药神》热映,票房突破30亿,获得电影圈数十个奖项,至今豆瓣评分仍在9分以上;这样一部叫好又叫座的电影,其剧情是根据“药侠”陆勇的真实故事改编,影片中的“救命药”---格列宁,在现实中的原型是格列卫(伊马替尼),它是由瑞士诺华公司开发的一种酪氨酸激酶抑制剂,于2001年5月10日获美国 FDA 批准上市,用于治疗慢性髓性白血病(CML)和恶性胃肠道间质肿瘤等。
影片引起了极大的社会关注度,然而当人体对格列卫产生耐药,是否还有救命药可用?伴有T315I突变的慢性髓性白血病患者对格列卫、甚至是“二代的格列卫”均耐药,在奥雷巴替尼出现之前,他们长期面临着这样无药可医治的窘境。
01 CML的发现和耐药
早在1840年,慢性髓性白血病首次被发现;但直到1960年,两位细胞遗传学家David Hungerford和Peter Nowell联合研究确定了该白血病与特定的染色体异常有关。随后,Janet Rowley在1973年进一步完善了这一发现。CML的特征是费城染色体的存在,9号和22号染色体长臂之间平衡相互易位[t (9;22) (q34;q11)],使得9号染色体上的ABL基因与22号染色体上的BCR基因融合,得到BCR- ABL1融合基因,该融合基因编码BCR-ABL癌蛋白。Ph 染色体作为CML的遗传学特征,见于90%~95%的CML病例之中,其编码的蛋白以P210为主。
与正常的AbL蛋白相比,融合蛋白具有较强的酪氨酸激酶活性,可促进细胞分裂,降低细胞对凋亡信号的反应,延长细胞存活时间,扰乱细胞正常的信号传导,诱导细胞恶变,导致白血病的发生。这些具有高分化能力的干细胞的持续增殖有利于产生突变,这些突变可以对标准治疗产生耐药,并对预后有负面影响。
图2.FDA批准上市的靶向ATP结合位点的BCR-ABL抑制剂
02 治疗手段(针对BCR-ABL的靶向药)
根据以上的发病机制,某些酪氨酸激酶抑制剂 (tyrosine kinase inhibitor,TKI)可抑制 BCR-ABL1的激酶活性,通过靶向BCR-ABL治疗达到持续缓解的CML患者生存期显著延长。BCR-ABL1 结构域上的某些点突变可导致伊马替尼耐药,第二代、第三代 BCR-ABL抑制剂 对大多数伊马替尼治疗失败的患者具有良好效果。目前已被证实的突变位点包括四类 :P-loop(phosphate-binding loop ;M244、G252、Y253、E255)、gatekeeper 残基(伊马替尼结合位点 ;T315、F317)、SH2 结合区和 C-lobe(催化域附近的突变 ;M351、F359)、活化 loop(H396)。
虽然已上市的 BCR-ABL抑制剂可以覆盖绝大多数耐药突变,但 T315I 突变(第315 位苏氨酸突变为异亮氨酸)依然是目前难以克服的突变之一。
图3.Asciminib的国内研发阶段
03 针对T315I突变的治疗策略
T315I 突变又被称为“gatekeeper 突变”,位于 ATP 结合位点,对伊马替尼、尼洛替尼、达沙替尼和博舒替尼均耐药。
普纳替尼(ponatinib)是第三代的BCR-ABL抑制剂,对目前所有的激酶点突变均有效,包括T315I,该药成为非常重要的临床选择。但普纳替尼存在安全性担忧:在距离普纳替尼加速审批还不到1年的时间(2013年10月31日),FDA 宣布鉴于普纳替尼“危及生命的血栓和血管重度狭窄”风险,要求生产商停止其销售和推广,这也是首个被撤市的小分子激酶抑制剂类抗肿瘤药。2013年12月20日,由于普纳替尼为T315I基因突变型慢性粒细胞白血病患者的唯一选择,故FDA在对其进行了风险效益评估,限制了适应证、添加了黑框警示与治疗相关的动脉血栓形成和肝脏毒性风险,在安全监控下再次批准其上市。目前普纳替尼在国内的最快研发阶段在临床二期(适应症为慢性髓细胞白血病等)。如今,奥雷巴替尼即将成为中国首个,全球第二个获批上市的三代BCR-ABL抑制剂。
对该T315I突变有效的,还有诺华的变构抑制剂。2021年10月29日,FDA批准了诺华的BCR-ABL的变构抑制剂Asciminib上市,用于治疗慢性粒细胞白血病;但是根据药渡数据库,目前Asciminib在国内的最快研发阶段是临床二期,适应症是髓样白血病;慢性髓细胞白血病的适应症处于临床一期阶段,远水难解近渴。
所幸的是亚盛医药研发的第三代BCR-ABL抑制剂奥雷巴替尼,针对T315I突变的髓系白血病加速期及慢性期的适应症即将在国内上市;胃肠道间质瘤处于临床一期。目前,奥雷巴替尼已获纳入CDE优先审评和突破性治疗品种。此外,其在美国已进入Ib期临床研究,还获得了美国FDA审评快速通道及孤儿药认证资格。
图4.奥雷巴替尼的国内研发阶段
图5.FDA已经批准上市的BCR-ABL抑制剂的结构
04 从药物分子与靶蛋白的结合来分析耐药机制
耐药的机制包括BCR-ABL1突变导致的耐药、非BCR-ABL1突变导致的耐药等;我们从点突变来进行分析。残基Thr315与imatinib 形成了氢键,而当 Thr315突变为较大的残基Ile315, 阻碍了imatinib与abl激酶结构域 ATP 结合口袋的结合;其中T315I突变约占所有点突变的25%。突变消除了imatinib与残基结合所需关键氢键的相互作用,并改变了ATP 结合口袋的拓扑结构,导致 iamtinib与该区域的结合受到结构性抑制。
第三代BCR-ABL抑制剂中普纳替尼,则不需要与苏氨酸315残基形成氢键,且分子中的炔烃基可以容纳 T315I 侧链,避免了与 I315 侧链之间的空间位阻冲突。含3个氮的双环骨架占用BCR-ABL的T315I 激酶的腺嘌呤口袋,甲基苯基占据后面残基的疏水口袋,三氟甲基苯基紧密结合由DFG 外构象诱导的口袋,而其N-甲基哌嗪基团则与ABL 形成2 种广泛氢键。通过与BCR-ABL激酶的疏水位点结合,造成构型失活,而非结合于活化的ATP 位点,从而能够避免与野生型BCR-ABL 的T315I 的侧链结合,形成有利于结合T315I 异亮氨酸突变侧链的范德华力,并改变异亮氨酸突变体的空间位阻,达到抑制T315I 的作用。临床前的体内体外活性数据也体现了这一基于结构设计的合理性。
图6.专利中的部分活性数据
05 奥雷巴替尼的发现与潜力
2010年,现暨南大学药学院院长丁克申请的化合物专利中,保护了一类杂环炔苯类化合物及其药用组合物;并公开了该杂环炔苯类化合物对各耐药细胞株的抑制活性,其中的D824(GZD824、HQP1351)正是现在的奥雷巴替尼,这应该是奥雷巴替尼首次披露结构;从图5可以看出该杂环炔苯类化合物对K562(慢性白血病)的抑制效果显著,其中奥雷巴替尼的IC50达到0.494 nM,对MOLT细胞的抑制在100nM以上;在肿瘤移植模型中能够显著抑制肿瘤的生长;在大鼠药代动力学和生物利用度的实验中证实了该类炔苯环化合物成药性非常好。
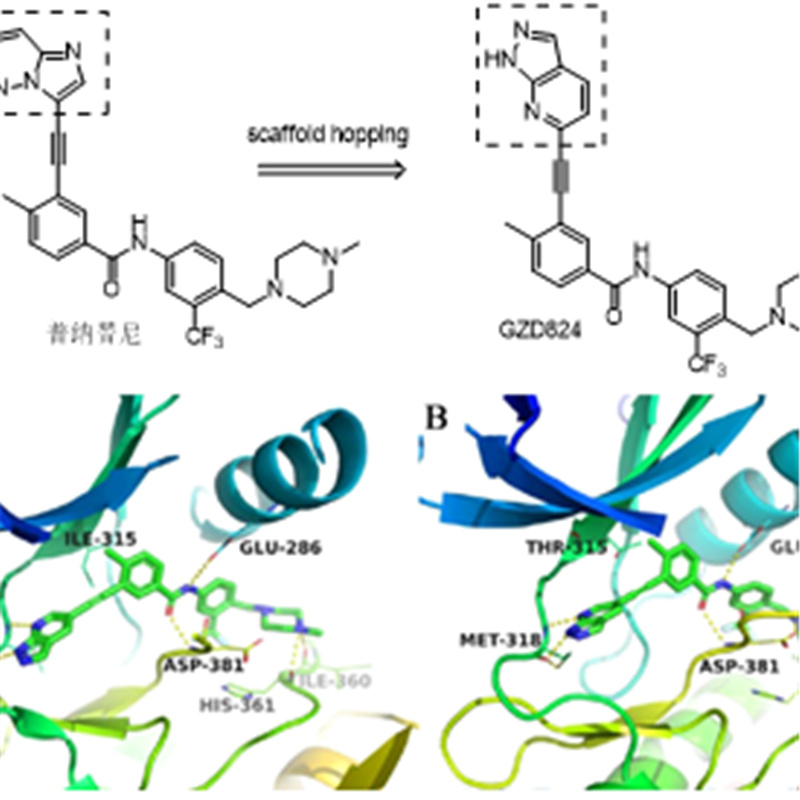
图7.奥雷巴替尼改造策略及预测的奥雷巴替尼与Bcr-Abl野生型和突变型的结合
在2013年的JMC中,丁克课题组通过骨架跃迁的策略,用1H-吡唑[3,4-b]并吡啶骨架替换普纳替尼的咪唑[1,2-b]并吡嗪骨架得到奥雷巴替尼,这样奥雷巴替尼可以和Met318形成一个新的氢键。奥雷巴替尼对野生型ABL蛋白激酶的抑制活性与普纳替尼相当,对T315I等各种突变体的活性优于普纳替尼。在细胞水平上也具有优秀的抗肿瘤活性,对BCR-ABL阳性的白血病细胞株K562和人CML细胞株的IC50达到了0.2nmol/L和0.13nmol/L。奥雷巴替尼在大鼠模型中具有良好的口服吸收,生物利用度达到48.7%,半衰期10.6h。奥雷巴替尼在1.0~20.0 mg/(kg*d)的口服剂量下能够完全抑制肿瘤生长。
图8.奥雷巴替尼对野生型和突变型的KIT酶的抑制
同时奥雷巴替尼还是一种针对广泛突变的KIT激酶的多激酶抑制剂(doi.org/10.1186/s13578-019-0351-6),可用于治疗伊马替尼耐药的胃肠道间质瘤。在临床试验,适应症的选择中,奥雷巴替尼主要靶向突变的BCR-ABL和KIT(胃肠道间质瘤相关),包括T315I。根据亚盛医药官方披露的信息,奥雷巴替尼治疗耐药性CML、胃肠道间质瘤、和费城染色体阳性急性淋巴细胞白血病的临床试验均在开展中。
第63届ASH年会的摘要日前刚刚公布,亚盛医药奥雷巴替尼的研究进展连续四年入选ASH口头报告。其中奥雷巴替尼治疗TKI耐药的BCR-ABLT315I突变的慢性髓性白血病慢性期和加速期(CML-CP和CML-AP)受试者的关键注册II期试验的最新结果获壁报展示。HQP1351-CC201和HQP1351-CC202是在中国进行的开放性、单臂、多中心的关键性注册II期临床研究,分别评估了奥雷巴替尼对TKI耐药(BCR-ABL1T315I突变)的CML-CP和CML-AP成人受试者的安全性和有效性。奥雷巴替尼的使用方式为40 mg口服、隔天给药、28天为一个周期。
•截至2020年8月25日,HQP1351-CC201共入组41例CML-CP患者,其中32例(78%)完成了≥12个周期,中位随访时间为13(3.1-16.3)个月。基线时没有反应的受试者在≥12个治疗周期后,CHR达到100%。MCyR为75.6%(31/41),CCyR率为68.3%(28/41),MMR为56.1%(23/41)。受试者在第12个月的PFS率为89.3%, 总生存(OS)率为100%。
•截至2020年7月27日,HQP1351-CC202共入组23例CML-AP患者,其中14例(61%)完成了≥12个周期,中位随访时间为13.5(1.4-15.2)个月。基线时没有反应的受试者在≥12个治疗周期后,血液学深度缓解率(MaHR)达到73.9%(17/23),MCyR为52.2%(12/23),CCyR为47.8%%(11/23),MMR为39.1%(9/23)。受试者在第12个月的PFS率为74.1%, OS率为91.3%。
奥雷巴替尼在治疗伴有T315I突变的TKI耐药的CML-CP及CML-AP患者时,最常见的血液学毒性就是血小板减少,而非血液学毒性绝大多数为1~2级,总体而言患者耐受性良好。且随着治疗时间的延长,缓解率和缓解深度会进一步增加。
目前,奥雷巴替尼的上市申请(受理号:CXHS2000038)已进入在审批阶段,预计将在近日获批,用于治疗伴有T315I突变的CML慢性期(CML-CP)及加速期(CML-AP)患者。相信上市后,奥雷巴替尼将打破中国携T315I突变耐药患者的治疗瓶颈,解决中国患者无药可用的窘境,并以其卓越的疗效和安全性,延续患者生命。
而根据亚盛医药披露的公开信息,该产品的正积极进行新适应症的拓展和海外临床试验。今年3月,奥雷巴替尼已获中国国家药品监督管理局(NMPA)新药审评中心(CDE)纳入突破性治疗品种,用于治疗一代和二代酪氨酸激酶抑制剂(TKI)耐药和/或不耐受的慢性期慢性髓性白血病(CP CML)患者。而在美国,奥雷巴替尼已进入Ib期临床研究,还获得了美国FDA授予的审评快速通道及孤儿药认证资格。我们也继续关注这一产品后续的表现。
参考文献:
1, Fabrício Freire de Melo et al; Chronic myeloid leukemia-from the Philadelphia chromosome tospecific target drugs: A literature review;World J Clin Oncol 2021 24; 12(2): 69-94.
2, Sara Malik, Shahzeb Hassan & Ahmet Emre Eşkazan;Novel BCR-ABL1 tyrosine kinase inhibitors in the treatment of chronic myeloid leukemia; DOI: 10.1080/17474086.2021.1990034.
3, Deepam Pushpam, Sameer Bakhshi;Pharmacology of tyrosine kinase inhibitors in chronic myeloid leukemia; a clinician’s perspective; DARU Journal of Pharmaceutical Sciences (2020) 28:371–385.
4, Xuechao Liu,Dajun Yang and Yifan Zhai et al; Preclinical development of HQP1351, a multikinase inhibitor targeting a broad spectrum of mutant KIT kinases, for the treatment of imatinib-resistant gastrointestinal stromal tumors; Cell Biosci (2019) 9:88.
5, 曹文静,李硕敏; BCR-ABL1 激酶抑制剂的疗效与耐药机制研究进展; 肿瘤药学2020年 12月第10卷第6期.
6, 张帆,闵钦威等;Bcr-Abl 酪氨酸激酶抑制剂及其耐药性的研究进展;
7,丁克,王德平等;杂环炔苯类化合物及其药用组合物和应用;CN101885722B。
8,Ke Ding et al; GZD824 as a FLT3, FGFR1 and PDGFRα Inhibitor Against Leukemia In Vitro and In Vivo; Translational Oncology 13 (2020) 100766.
9,Ke Ding et al; Identification of GZD824 as an Orally Bioavailable Inhibitor That Targets Phosphorylated and Nonphosphorylated Breakpoint Cluster Region−Abelson (Bcr-Abl) Kinase and Overcomes Clinically Acquired Mutation-Induced Resistance against Imatinib; J. Med. Chem. 2013, 56, 879−894.
10,亚盛医药公众号:亚盛医药抗耐药白血病新药奥雷巴替尼临床进展第四次入选ASH年会口头报告,该品种共三项研究获选;
11,药渡数据库;
12,药渡系列丛书:盛春泉,李剑著;《药物结构优化》。